Heyho, Volastars. Maaf ya, baru nongol lagi. Minvola abis sibuk siap-siap CPNS nih, hahaha. Doain ya, semoga keterima. Langsung aja yuk masuk ke bahasan mengenai sifat koligatif larutan.
Memahami sifat koligatif larutan itu penting banget ketika kita mempelajari ilmu kimia, karena konsep ini bantu kita ngerti gimana larutan berperilaku saat bercampur dengan zat lain. Sifat koligatif kayak penurunan titik beku atau peningkatan titik didih bisa jelasin fenomena sehari-hari, misalnya kenapa air laut nggak gampang beku atau gimana cara bikin es krim lebih cepat beku. Selain itu, konsep ini juga jadi dasar buat banyak eksperimen dan aplikasi di bidang kimia, farmasi, dan industri makanan. Jadi, ngerti sifat koligatif bisa bikin kita lebih paham dan siap menghadapi tantangan di dunia kimia. Pada artikel ini, Minvola akan membahas seluk beluk sifat koligatif larutan, dari pengertian, jenis-jenis, sampai penerapan sifat koligatif larutan, simak yuk.
Pengertian Sifat Koligatif Larutan

Source: Wikimedia
Sifat koligatif larutan adalah efek yang muncul gara-gara ada zat terlarut di dalam larutan, dan efek ini nggak tergantung sama jenis zat terlarutnya, tapi tergantung jumlah zat terlarut. Jadi, misalnya, kalau kamu melarutkan garam atau gula ke dalam air, sifat koligatifnya bakal bikin air itu punya titik beku lebih rendah atau titik didih lebih tinggi daripada air biasa. Sifat koligatif fokus ke gimana jumlah partikel zat terlarut bisa ngubah sifat-sifat dasar dari larutan itu.
Contoh sehari-hari dari sifat koligatif larutan tuh pas bikin es krim di rumah. Sebagai contoh, kalian pasti pernah liat orang yang nambahin garam ke es batu di sekitar wadah es krimnya biar es krim cepet beku. Nah, garam ini bikin titik beku air turun, jadi es krim bisa lebih cepet beku meskipun suhunya nggak sedingin freezer. Contoh lain, air laut yang asin nggak gampang beku daripada air tawar karena kandungan garamnya bikin titik beku air laut jadi lebih rendah. Volastars, ngomong-ngomong soal air laut nih, kalian tau ga sih kenapa air laut selalu punya kandungan garam? Kenapa air laut asin? Kalau penasaran, monggo dicek artikel kita tentang kenapa air laut asin, ya.
Konsentrasi Larutan
Konsentrasi larutan berfungsi untuk mengukur jumlah partikel zat terlarut dalam larutan. Satuan konsentrasi ini ada beberapa jenis, yaitu molaritas (M), molalitas (m), dan fraksi mol (X). Yuk, kita bahas satu-satu!
Molaritas (M)
Molaritas adalah ukuran konsentrasi suatu larutan yang dinyatakan sebagai jumlah mol zat terlarut per liter larutan. Sering muncul dalam berbagai perhitungan kimia karena memudahkan dalam menentukan jumlah zat terlarut dalam volume tertentu. Rumus untuk menghitung molaritas adalah:
Keterangan:
M = molaritas (mol/L)
n = mol
V = volume larutan (L)
Molalitas (m)
Molalitas adalah ukuran konsentrasi yang dinyatakan sebagai jumlah mol zat terlarut per kilogram pelarut. Tidak seperti molaritas, molalitas tidak dipengaruhi oleh perubahan suhu atau tekanan karena didasarkan pada massa pelarut, bukan volume larutan. Rumus untuk menghitung molalitas adalah:
Keterangan:
m = molalitas (mol/kg)
n = mol
m = massa (kg)
Fraksi Mol (X)
Fraksi mol adalah perbandingan jumlah mol suatu komponen terhadap jumlah mol total semua komponen dalam campuran. Tidak seperti yang lain, fraksi mol tidak memiliki satuan dan sering digunakan untuk menyatakan komposisi campuran. Maka dari itu, rumus untuk menghitung fraksi mol suatu komponen adalah:
Keterangan:
x = fraksi mol
n = mol
Jenis-Jenis Sifat Koligatif Larutan
Penurunan Tekanan Uap
Pertama-tama, bayangin kamu lagi ngeluarin baju basah dari mesin cuci. Kemudian, pas kamu jemur baju itu, airnya lama-lama menguap, kan? Nah, tekanan uap itu kayak kekuatan air buat berubah wujud dari air ke uap. Bisa dibilang, air berusaha buat ‘ngeluarin’ diri dari larutan. Kedua, bayangin kamu tambahin garam ke air. Garam ini kayak ngeganggu air buat ‘ngeluarin’ diri, jadi tekanan uapnya jadi lebih rendah. Makanya, air asin lebih susah menguap dibanding air biasa. Jadi, penurunan tekanan uap itu kayak gimana efek zat terlarut di dalam air bikin air jadi lebih malas buat ‘ngeluarin’ diri dari larutan. Oleh karena itu, semakin banyak zat terlarutnya, semakin malas airnya buat ‘ngeluarin’ diri, dan tekanan uapnya makin rendah.
Hukum Raoult
Hukum Raoult menyatakan bahwa penurunan tekanan uap suatu pelarut dalam larutan ideal sebanding dengan fraksi mol zat terlarut dalam larutan tersebut. Dalam konteks larutan biner, hukum ini dapat dinyatakan sebagai berikut: tekanan uap larutan adalah hasil kali dari fraksi mol pelarut dalam larutan dan tekanan uap pelarut murni. Secara matematis, Hukum Raoult dinyatakan sebagai berikut:
Keterangan:
ΔP = P0 – P = kenaikan tekanan uap = selisih antara tekanan uap pelarut murni dan tekanan uap larutan (mmHg)
xt = fraksi mol zat terlarut
P0 = tekanan uap pelarut murni (mmHg)
Jika ΔP = P0 – P, maka P = P0 – ΔP
Substitusikan rumus Hukum Raoult ΔP = xt × P0 ke dalam persamaan P = P0 – ΔP
Sederhanakan persamaan tersebut menjadi
P = P0 × (1 – xt)
Berdasarkan rumus fraksi mol 1 = x0 + xt, maka x0 = 1 – xt, substitusikan ke persamaan di atas:
Keterangan:
P = tekanan uap larutan (mmHg)
x0 = fraksi mol pelarut dalam larutan
P0 = tekanan uap pelarut murni (mmHg)
Peningkatan Titik Didih
Bayangin kamu lagi masak air buat bikin mie. Biasanya kan air mendidih di suhu 100 derajat Celcius nih. Di sisi lain, kalau kamu tambahin garam ke air, airnya bakal mendidih di suhu yang lebih tinggi dari 100 derajat Celcius. Kenapa? Karena garam ini kayak ngeganggu air buat berubah wujud jadi uap, jadi airnya butuh suhu yang lebih tinggi buat mendidih. Jadi, peningkatan titik didih itu kayak gimana air jadi lebih bandel buat mendidih gara-gara ada zat terlarut di dalamnya. Akhirnya, semakin banyak zat terlarutnya, semakin bandel airnya buat mendidih, dan titik didihnya makin tinggi. Dari contoh di atas, berarti titik didih air yang sudah diberi garam akan menjadi lebih tinggi dibanding titik didih air murni. Secara matematis, peningkatan titik didih bisa dinyatakan sebagai berikut:
Keterangan:
ΔTb = peningkatan titik didih (°C)
Tb = titik didih larutan (°C)
Tb0 = titik didih pelarut (°C)
Secara umum, semakin banyak jumlah zat terlarut dalam suatu larutan, berarti semakin banyak pula zat terlarut yang jadi ‘pengganggu’ bagi pelarut untuk mendidih. Akibatnya, peningkatan titik didihnya akan semakin besar. Oleh karena itu, persamaan untuk menentukan peningkatan titik didih (ΔTb) sebanding dengan perkalian antara molalitas (m) dan konstanta peningkatan titik didih molal (Kb) dari pelarut tersebut, yang secara matematis bisa dituliskan sebagai berikut:
Keterangan:
ΔTb = peningkatan titik didih (°C)
m = konsentrasi larutan (molal = mol/kg)
Kb = konstanta peningkatan titik didih molal (°C/molal = °C·kg/mol)
Tabel Titik Didih dan Kb
Konstanta peningkatan titik didih molal merupakan nilai tetapan yang digunakan untuk menghitung seberapa besar peningkatan titik didih suatu pelarut ketika zat terlarut ditambahkan. Tetapi, setiap pelarut memiliki nilai Kb yang berbeda, tergantung pada sifat fisiknya. Berikut ini tabel titik didih dan Kb tiap pelarut yang umum digunakan:
| Pelarut | Titik Didih (°C) | Kb (°C.kg/mol) |
|---|---|---|
| Air | 100 | 0,512 |
| Aseton | 56 | 1,71 |
| Benzen | 80,1 | 2,53 |
| Kamper | 204 | 5,95 |
| Karbon Tetraklorida | 76,7 | 5,03 |
| Sikloheksana | 80,7 | 2,79 |
| Naftalen | 218 | 6,94 |
| Fenol | 181,7 | 3,56 |
| Etil Alkohol | 78,4 | 1,22 |
| Kloroform | 61,2 | 3,63 |
| Dietil Eter | 34,6 | 2,02 |
Penurunan Titik Beku
Bayangin gini, kamu lagi bikin es batu di kulkas. Biasanya kan air beku di suhu 0 derajat Celcius nih. Tetapi, kalau kamu tambahin garam ke air, airnya bakal beku di suhu yang lebih rendah dari 0 derajat Celcius. Karena garam ini kayak ngeganggu air buat berubah wujud jadi es, jadi airnya butuh suhu yang lebih dingin buat beku. Jadi, penurunan titik beku itu kayak gimana air jadi lebih bandel buat beku gara-gara ada zat terlarut di dalamnya. Maka dari itu, semakin banyak zat terlarutnya, semakin bandel airnya buat beku, dan titik bekunya makin rendah.
Berdasarkan contoh di atas, air yang mengandung zat terlarut akan membeku pada suhu yang lebih rendah dibanding air murni. Sehingga, penurunan titik beku (ΔTf) merupakan selisih titik beku pelarut murni (Tf0) dengan titik beku larutan (Tf).
Secara umum, semakin banyak jumlah zat terlarut dalam suatu larutan, berarti semakin banyak pula zat terlarut yang jadi ‘pengganggu’ bagi pelarut untuk membeku. Akibatnya, penurunan titik bekunya akan semakin besar. Oleh karena itu, persamaan untuk menentukan penurunan titik beku (ΔTf) sebanding dengan perkalian antara molalitas (m) dan konstanta penurunan titik beku molal (Kf) dari pelarut tersebut, yang secara matematis bisa dituliskan sebagai berikut:
Keterangan:
ΔTf = penurunan titik beku (°C)
m = konsentrasi larutan (molal = mol/kg)
Kb = konstanta penurunan titik beku molal (°C/molal = °C·kg/mol)
Tabel Titik Beku dan Kf
Konstanta penurunan titik beku molal merupakan nilai tetapan yang digunakan untuk menghitung seberapa besar penurunan titik beku suatu pelarut ketika zat terlarut ditambahkan. Namun, setiap pelarut memiliki nilai Kf yang berbeda, tergantung pada sifat fisiknya. Berikut ini tabel titik beku dan Kf tiap pelarut yang umum digunakan:
| Pelarut | Titik Beku (°C) | Kf (°C·kg/mol) |
|---|---|---|
| Air | 0,0 | 1,86 |
| Aseton | -94,8 | 2,07 |
| Benzen | 5,5 | 5,12 |
| Kamper | 178,4 | 40,0 |
| Karbon Tetraklorida | -22,9 | 29,8 |
| Sikloheksana | 6,5 | 20,0 |
| Naftalen | 80,2 | 6,94 |
| Fenol | 40,9 | 7,27 |
| Etil Alkohol | -114,1 | 1,99 |
| Kloroform | -63,5 | 4,68 |
| Dietil Eter | -116,3 | 1,79 |
Tekanan Osmotik
Pertama-tama, bayangin kamu punya 2 wadah, wadah 1 isinya air biasa, dan wadah 2 isinya air yang udah dicampur gula. Kemudian, selaput tipis ini cuma bisa dilalui air, bukan gula. Karena ada perbedaan konsentrasi, air bakal ngalir dari wadah yang konsentrasinya lebih rendah (air biasa) ke wadah yang konsentrasinya lebih tinggi (air dengan gula) buat nyoba nyamain konsentrasi di kedua sisi. Aliran ini terjadi secara alami karena sifat osmosis, dan tekanan yang dibutuhkan buat ngehentikan aliran air ini disebut tekanan osmotik. Jadi, semakin banyak gula (atau zat terlarut lainnya) di satu wadah, semakin besar tekanan osmotik yang dibutuhkan buat ngehentikan aliran air tersebut
Jadi, tekanan osmotik adalah tekanan yang diperlukan untuk menghentikan air mengalir melalui membran semipermeabel. Membran ini seperti saringan yang hanya membiarkan air lewat, tetapi zat lain seperti garam atau gula tidak dibiarkan lewat.
Hukum van’t Hoff untuk tekanan osmotik merupakan analogi dari persamaan gas ideal yang dinyatakan dalam bentuk PV = nRT. Namun, dalam konteks tekanan osmotik, hukum van’t Hoff menyatakan bahwa tekanan osmotik (π) dari suatu larutan sebanding dengan molaritas (M) dari zat terlarut, konstanta gas ideal (R), dan suhu absolut (T) dalam Kelvin. Jadi, hukum ini menggambarkan bahwa tekanan osmotik meningkat dengan bertambahnya konsentrasi zat terlarut dan suhu. Dengan kata lain, semakin tinggi konsentrasi zat terlarut dalam larutan, semakin besar tekanan osmotik yang dihasilkan. Secara matematis, dapat dinyatakan sebagai berikut ini:
Ingat rumus molaritas M = n/V? Substitusi molaritas ke dalam persamaan di atas
Dengan:
P = tekanan
П = tekanan osmotik (atm)
V = volume larutan (L)
n = mol zat terlarut
M = molaritas (mol/L)
R = konstanta gas ideal, yang nilainya sekitar 0,0821 L·atm/mol·K
T = suhu larutan (K)
Faktor Van’t Hoff
Faktor van’t Hoff, yang dilambangkan dengan i, adalah konsep penting dalam memahami sifat koligatif larutan, khususnya ketika melibatkan zat terlarut yang dapat terdisosiasi menjadi ion-ion. Perhitungan i berfungsi untuk memperhitungkan efek dari jumlah partikel terlarut yang dihasilkan setelah disosiasi atau asosiasi dalam larutan.
Untuk Zat Elektrolit
Untuk zat elektrolit, yang dapat terdisosiasi menjadi ion-ion, faktor van’t Hoff (i) lebih besar dari 1. Dengan kata lain, nilai i mencerminkan jumlah total partikel ionik yang dihasilkan dari satu molekul zat terlarut. Misalnya:
- Untuk natrium klorida (NaCl), yang terdisosiasi menjadi Na⁺ dan Cl⁻, faktor van’t Hoff adalah 2 karena satu molekul NaCl menghasilkan 2 ion.
- Untuk kalsium klorida (CaCl₂), yang terdisosiasi menjadi satu ion Ca²⁺ dan dua ion Cl⁻, faktor van’t Hoff adalah 3 karena satu molekul CaCl2 menghasilkan 3 ion.
Untuk Zat Non Elektrolit
Untuk zat non-elektrolit, seperti glukosa atau urea, yang tidak terdisosiasi menjadi ion dalam larutan, faktor van’t Hoff (i) adalah 1. Berarti, jumlah partikel dalam larutan sama dengan jumlah molekul zat terlarut yang ditambahkan.
Untuk Derajat Ionisasi Tidak Sempurna
Dalam kasus di mana derajat ionisasi (α) tidak sempurna, rumus berikut dapat digunakan untuk menghitung i:
Keterangan:
n = jumlah total partikel setelah disosiasi
α = derajat ionisasi, yang menunjukkan proporsi zat terlarut yang terdisosiasi jadi ion
Contoh Soal Latihan Sifat Koligatif Larutan
- Fufu melarutkan 100 gram glukosa (C₆H₁₂O₆) ke dalam 400 gram air. Tekanan uap air murni pada suhu tertentu adalah 23,8 mmHg. Hitunglah penurunan tekanan uap larutan tersebut. (Massa molar glukosa =180 g/mol).
- Fafa melarutkan 50 gram urea (CH₄N₂O) ke dalam 500 gram air. Hitunglah peningkatan titik didih dan titik didih larutan tersebut. (Massa molar urea = 60 g/mol dan konstanta peningkatan titik didih molal (Kb) air = 0,512 °C·kg/mol).
- Fifi melarutkan 40 gram kalsium klorida (CaCl₂) ke dalam 300 gram air. Hitunglah penurunan titik beku larutan tersebut. Asumsikan bahwa CaCl₂ terdisosiasi sempurna menjadi ion Ca²⁺ dan Cl⁻. (Massa molar CaCl₂ = 111 g/mol dan konstanta penurunan titik beku molal (Kf) air = 1,86 °C·kg/mol)
- Fefe melarutkan 15 gram glukosa (C₆H₁₂O₆) dan 10 gram natrium klorida (NaCl) ke dalam 500 mL air. Hitunglah tekanan osmotik larutan tersebut pada suhu 27°C. (Massa molar glukosa = 180 g/mol, massa molar NaCl = 58,5 g/mol, dan konstanta gas ideal R = 0,0821 L·atm/mol·K). Asumsikan bahwa NaCl terdisosiasi sempurna menjadi ion Na⁺ dan Cl⁻.
- Suatu larutan KOH dalam air membeku pada suhu -1,12 °C. Jika Kf air = 1,86 °C/molal dan Kb air = 0,52 °C/molal, tentukan titik didih larutan KOH tersebut.
- Sebanyak 3,7 g suatu zat basa bervalensi dua dalam 500 g air mendidih pada suhu 100,104 oC. Jika derajat ionisasi sebesar 0,5 dan Kb air = 0,52 oC/molal, massa atom relatif logam basa adalah…
Pembahasan Soal Latihan Sifat Koligatif Larutan
Nomor 1
Keterangan:
w glukosa = 100 g
Mr glukosa = 180 g/mol
w air (pelarut) = 400 g
Mr air = 18 g/mol
P0 air = 23,8 mmHg
Penurunan tekanan uap = ΔP?
Jawaban:
Pertama-tama, kita hitung mol glukosa
Kedua, kita hitung mol air
Ketiga, hitung fraksi mol zat terlarut
Keempat, hitung penurunan tekanan uap
Jadi, penurunan tekanan uap larutan tersebut sebesar 0,58 mmHg.
Nomor 2
Keterangan:
w urea = 50 g
Mr urea = 60 g/mol
w air (pelarut) = 500 g = 0,5 kg
Kb air = 0,512 °C·kg/mol
Tb0 air = 100 °C
Peningkatan titik didih = ΔTb?
Titik didih = Tb?
Jawaban:
Pertama-tama, hitung mol urea
Kedua, hitung molalitas
Ketiga, hitung peningkatan titik didih
Keempat, hitung titik didih
Jadi, peningkatan titik didih larutan tersebut sebesar 0,853°C dan titik didih larutan tersebut sebesar 100,853°C
Nomor 3
Keterangan:
w CaCl2 = 40 g
Mr CaCl2 = 111 g/mol
w air (pelarut) = 300 g = 0,3 kg
Kf = 1,86 °C·kg/mol
Penurunan titik beku = ΔTf?
Jawaban:
Pertama-tama, kita menghitung mol CaCl2
Kedua, kita menghitung partikel terlarut dari CaCl2
CaCl2 terdisosiasi menjadi Ca²⁺ dan 2 Cl⁻, sehingga faktor van’t Hoff (i) = 3. Kemudian, hitung mol partikel terlarut
Lalu, kita menghitung molalitas partikel terlarut
Selanjutnya, hitung penurunan titik beku larutan
Jadi, penurunan titik beku larutan sebesar 6,70 °C.
Nomor 4
Keterangan:
w glukosa = 15 g
Mr glukosa = 180 g/mol
w NaCl = 10 g
Mr NaCl = 58,5 g/mol
v larutan = 500 mL = 0,5 L
T = 27 °C = 300 K
Tekanan osmotik = П?
Jawaban:
Pertama-tama, hitung mol glukosa
Kedua, hitung mol NaCl
Ketiga, hitung jumlah partikel terlarut dari NaCl
NaCl terdisosiasi menjadi Na⁺ dan Cl⁻, sehingga faktor van’t Hoff (i) = 2. Kemudian, hitung mol partikel terlarut
Selanjutnya, hitung total mol partikel terlarut
Lalu, hitung molaritas partikel terlarut
Dan akhirnya, kita bisa hitung tekanan osmotik
Jadi, tekanan osmotik larutan tersebut pada suhu 27°C adalah sekitar 20,92 atm
Nomor 5
Keterangan:
Tf0 air = 0°C
Tf larutan = -1,12°C
Kf air = 1,86 °C·kg/mol
Kb air = 0,52 °C·kg/mol
Mr KOH = 56 g/mol
Jawaban:
Pertama-tama, hitung penurunan titik beku
Kedua, hitung jumlah partikel terlarut dari KOH
KOH terdisosiasi menjadi K⁺ dan OH⁻, sehingga faktor van’t Hoff (i) = 2. Hitung molalitas (m) dengan rumus:
Lalu, hitung peningkatan titik didih
Terakhir, hitung titik didih larutan
Jadi, jika larutan KOH memiliki titik beku -1,12°C, titik didihnya adalah 100,313°C
Nomor 6
Keterangan:
w zat basa bervalensi 2 = 3,7 g
w pelarut = 500 g
Tb = 100,104 °C
Tb0 air = 100 °C
α = 0,5
Kb air = 0,52 °C·kg/mol
Ar logam basa?
Jawaban:
Pertama-tama, hitung peningkatan titik didih
Basa bervalensi 2, berarti punya rumus M(OH)2 dan terdisosiasi sebagai berikut:
Berarti, total partikel setelah disosiasi 3, tapi karena derajat ionisasinya 0,5, maka I perlu dihitung dengan rumus:
Lalu, hitung molalitas zat basa
Jika rumus basa M(OH)2, maka:
Maka, massa atom relatif logam basa tersebut 40 g/mol, bisa jadi itu adalah kalsium.
Penerapan Sifat Koligatif dalam Kehidupan Sehari-hari
Penurunan Tekanan Uap

Source: Wikimedia
Salah satu penerapan penurunan tekanan uap yang biasa kita lihat sehari-hari yaitu pas rebus makanan. Ketika kita tambahin garam ke air rebusan, tekanan uap air jadi turun. Ini artinya, air butuh suhu lebih tinggi buat mendidih. Jadi, makanan bisa matang lebih cepat karena airnya lebih panas daripada ketika kita hanya mendidihkan air dan tidak menambahkan garam.
Contoh lainnya, pas kita pakai humidifier di rumah. Humidifier bisa bantu ningkatin kelembapan di ruangan dengan cara menyemprotkan uap air. Nah, kalau kita tambahin sedikit zat terlarut, kayak aroma terapi, tekanan uap air bakal turun, bikin uap lebih lama bertahan di udara dan bikin ruangan lebih lembap lebih lama.
Peningkatan Titik Didih

Source: Wikimedia
Salah satu penerapan peningkatan titik didih yang gampang kita lihat sehari-hari, yaitu, pada daerah yang sering turun salju, orang-orang kadang menambahkan zat terlarut ke air radiator mobil biar titik didihnya naik. Zat terlarut ini biasa disebut juga sebagai antifreeze yang terbuat dari etilen glikol atau propilen glikol. Fungsinya buat meningkatkan titik didih air radiator dan juga menurunkan titik bekunya. Jadi, pas cuaca panas, air radiator nggak gampang nge-didih, dan pas cuaca dingin, nggak gampang beku.
Contoh lainnya, di industri pembuatan sirup atau permen. Pas bikin sirup, ada proses penambahan gula. Gula bisa bikin titik didih air naik, jadi sirup bisa mengental lebih cepat tanpa harus mendidih berlebihan.
Penurunan Titik Beku

Source: Wikimedia
Salah satu penerapan penurunan titik beku yang sering kita temuin sehari-hari itu pas musim dingin di negara yang ada saljunya. Biasanya, orang-orang bakal nyebarin garam di jalanan atau trotoar yang bersalju. Garam ini bantu nurunin titik beku air, jadi es atau salju lebih cepet meleleh dan jalanan jadi nggak licin.
Contoh lainnya, pas kita nyimpen makanan di freezer. Makanan yang punya kandungan garam atau gula yang tinggi, kayak daging yang diasinkan atau buah-buahan yang dikeringkan dengan gula, titik beku makanan itu bakal lebih rendah. Jadi, makanan bisa lebih awet dan nggak gampang beku + keras, jadi lebih gampang ngolahnya.
Tekanan Osmotik
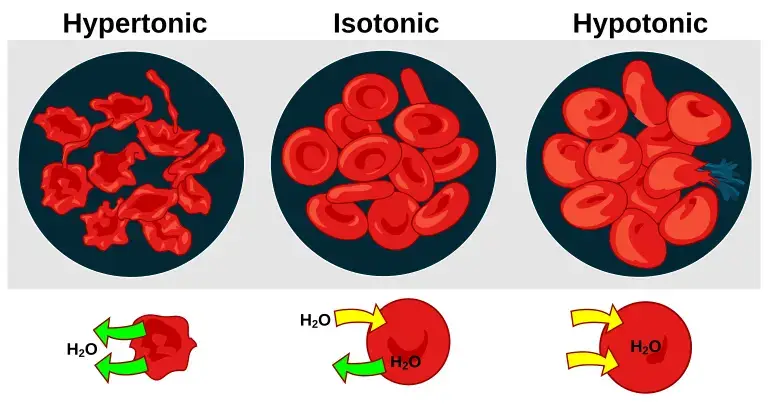
Source: Wikimedia
Tekanan osmotik punya banyak peran penting di kehidupan sehari-hari, meskipun kadang kita nggak nyadar. Salah satu contohnya ada di tubuh kita sendiri. Proses osmosis penting banget buat ngatur keseimbangan cairan di dalam sel-sel tubuh. Misalnya, pas kita minum air, tekanan osmotik bantu air masuk ke dalam sel biar sel tetap sehat dan berfungsi dengan baik.
Proses cuci hidung atau yang nasal irrigation juga memanfaatkan tekanan osmotik. Jadi, pas kita cuci hidung pake larutan saline, larutan ini punya tekanan osmotik yang mirip sama cairan tubuh kita. Karena tekanan osmotiknya seimbang, larutan saline bisa bantu bersihin lendir, debu, atau alergen dari rongga hidung tanpa bikin iritasi. Ini bikin hidung jadi lebih lega dan bersih, terutama pas lagi flu atau alergi. Nah, kebetulan Minvola saat lagi tulis artikel ini juga lagi pilek dan rutin cuci hidung nih, lega banget deh kalo udah ngelakuin nasal irrigation. Kalo ada yang belum coba, cobain deh nanti pas lagi flu, hahaha.
Penutup
Yeay, Volastars baru aja selesai mempelajari sifat koligatif larutan beserta penerapannya di kehidupan sehari-hari. Mulai dari penurunan tekanan uap, peningkatan titik didih, penurunan titik beku, sampai tekanan osmotik, semua punya peran penting di kehidupan kita. Contoh-contoh nyata kayak gimana garam bisa bikin es di jalanan cepet cair atau kenapa air laut di negara bersalju nggak gampang beku, bikin kita jadi lebih ngerti gimana larutan berperilaku. Semakin kita belajar tentang sifat koligatif larutan, semakin kita sadar bahwa kimia itu beneran banyak manfaatnya di hidup kita. Nih, kalau mau baca manfaat kimia lainnya di kehidupan sehari-hari.
Oh iya, Minvola juga udah kasih beberapa contoh soal yang mudah-mudahan bisa bantu Volastars untuk memahami konsep ini. Kalau punya contoh soal yang ingin didiskusikan bersama, monggo drop aja di kolom komentar ya. Artikel ini akan diupdate kalau ada soal yang perlu didiskusikan. Jadi, jangan sungkan-sungkan buat nanya ke Minvola. Bye!
Referensi Buku Tentang Sifat Koligatif Larutan
- Atkins, P., & de Paula, J. (2010). Physical Chemistry. Oxford University Press.
- Chang, R. (2005). Kimia Dasar: Konsep-Konsep Inti. Erlangga.
- Petrucci, R. H., Herring, F. G., Madura, J. D., & Bissonnette, C. (2011). General Chemistry: Principles and Modern Applications. Pearson.
- Silbey, R. J., Alberty, R. A., & Bawendi, M. G. (2004). Physical Chemistry. Wiley.


2 thoughts on “Sifat Koligatif Larutan: Konsep Penting, Pelajar Wajib Tahu!”